접힘 보조 단백질, 세포 내에서 특수 단위로 스스로 조직
- 2025년 8월 13일
- 3분 분량
생물학자들은 우리 세포 내에 아미노산 사슬이 조립 라인처럼 기능성 단백질로 접히는 작은 공장들이 존재한다는 것을 발견했다. 연구진에 따르면, 새로 생성된 단백질을 3차원 형태로 변형시키는 이미 알려진 보조 단백질은 이전에는 알려지지 않았던 특수 단위, 즉 물방울과 같은 응축물로 조직된다. 이러한 "공장"이 없으면 접힘 보조 단백질이 더 많은 오류를 발생시키고 당뇨병과 같은 질병이 발생한다고 연구팀은 보고했다.

단백질은 세포 내에서 다양한 기능을 수행한다. 예를 들어, 물질을 운반하고, 효소로서 소화를 돕고, 구성 요소 역할을 한다. 이러한 기능을 수행하기 위해 세포의 리보솜 단백질 공장에서 생성된 아미노산 사슬은 올바른 3차원 구조로 배열되어야 한다. 따라서 긴 사슬이 올바르게 접혀야 한다.
샤페론(Chaperone)은 어떤 역할을 하나요?
이 단백질 접힘은 샤페론이라는 다양한 보조 단백질에 의해 촉진된다. 이러한 접힘 보조 단백질은 특히 세포 내 막 구조인 소포체(ER:endoplasmic reticulum)에 많이 존재한다. 소포체는 대부분 단백질이 완성되는 곳이며, 리보솜에서 "탄생"하는 즉시 소포체에 있는 샤페론에 의해 단백질이 형성된다.
바젤 대학교의 안나 레더(Anna Leder)가 이끄는 연구진은 이러한 샤페론 중 하나인 PDIA6를 더욱 자세히 연구했다. 이 보조 단백질에 돌연변이가 있는 사람들은 간 섬유증, 당뇨병, 신경 퇴행성 질환 등의 질병을 겪는 경우가 많다. 따라서 연구팀은 다양한 세포 유형을 대상으로 일련의 실험을 수행하여 이 샤페론의 정확한 기능과 질병과의 연관성을 분석했다.
조립 라인의 접힘 보조 단백질
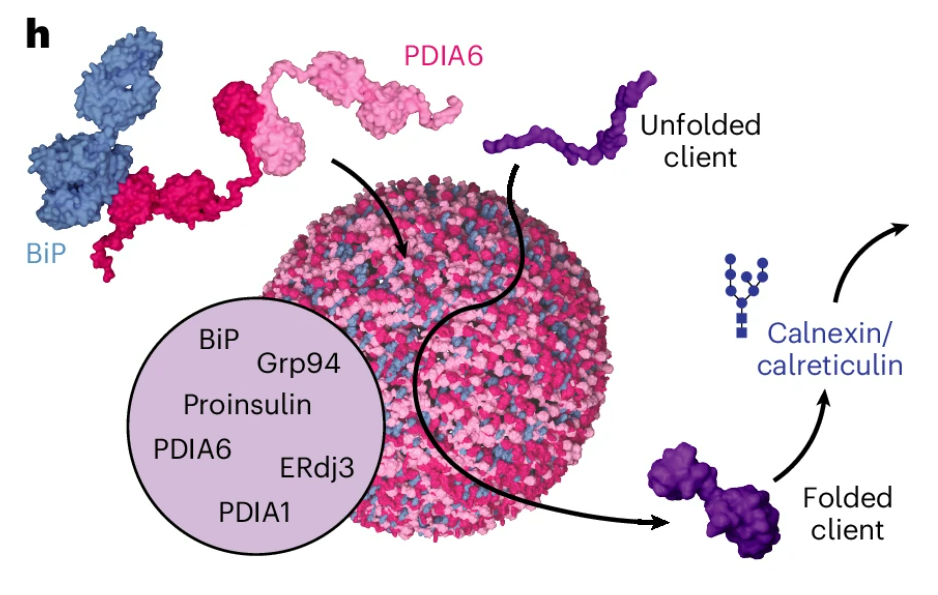
생물학자들은 놀랍게도 PDIA6와 다른 샤페론들이 세포 내에서 독립적으로 특수한 단위로 조립된다는 사실을 발견했다. 그 원동력이자 기본 골격은 바로 PDIA6이다. 이 분자들은 먼저 칼슘 이온과 상호작용하고, 그다음 서로 작용하며, 이후 수많은 다른 샤페론들이 이 구조에 합류한다.
레더는 "접힘 보조 단백질은 소포체 내에서 개별적으로 떠다닌다고 전통적으로 생각되었다"고 말했다. "하지만 우리는 이들이 독립적으로 조직되어 응축물이라는 물방울 모양의 구조를 형성한다는 것을 발견했다"고 연구진은 설명했다. 이러한 응축물은 작은 “접힘 공장”을 나타내는데, 그곳에서 단백질 접힘 보조 단백질들이 조립 라인의 기계처럼 배열돼 있다고 설명했다.
"공장"에 샤페론이 이렇게 집중되면 공간적, 시간적으로 효율적인 과정이 보장되고 개별 접힘 보조 단백질의 기능이 최적화된다. 따라서 응축물은 단백질 접힘의 효율성을 높이고 품질 관리 역할도 한다. 레더는 "이 위치에서 접힘 보조 단백질의 농도가 매우 높기 때문에 접히지 않거나 잘못 접힌 단백질이 말 그대로 끌려들어간다"며 "단백질이 올바르게 접혔을 때만 방출된다"고 설명했다.
접힘 공장 부족으로 인한 질병
하지만 PDI(protein disulfide isomerase)A6에 돌연변이가 생겨 결함이 생겨 자발적인 접힘 공장이 형성되지 않으면 어떻게 될까? 개별 샤페론은 단백질 접힘 작업을 계속하지만, 실험 결과에서 알 수 있듯이 더 많은 오류를 범한다. 이로 인해 접히지 않거나 잘못 접힌 단백질이 많이 생성된다. 이는 개별 세포가 분해되어 불필요한 접힘을 보충해야 하기 때문에 스트레스를 유발한다.
이 과정이 실패하면 유해한 단백질 플라크나 덩어리가 형성된다. 더 나아가, 영향을 받은 사람의 신체에는 특정 단백질의 완전히 접히고 기능하는 버전이 너무 적다. 혈당을 조절하는 호르몬인 인슐린이 그 예다. 레더는 "전구체인슐린은 응축물 내에서만 제대로 접힌다. PDIA6 샤페론에 돌연변이가 있는 세포에서는 이러한 응축물이 형성되지 않는다. 따라서 인슐린을 덜 생산하고 분비량도 줄어든다"고 보고했다.
따라서 PDIA6 돌연변이 환자는 당뇨병을 비롯한 여러 질환을 앓게 된다. 하지만 신경퇴행성 질환, 낭포성 섬유증, 암을 포함한 수많은 다른 질병들도 잘못 접힌 단백질과 관련이 있다.
필수 단위
연구진은 새롭게 발견된 샤페론 응축물이 단순히 가끔씩 무작위로 발생하는 것이 아니라 우리 세포의 필수적인 조직 단위를 나타낸다고 결론지었다. 바젤 대학교의 수석 저자인 세바스찬 힐러(Sebastian Hiller)는 "소포체(ER)의 기능은 응축물의 존재를 통해서만 설명하고 진정으로 이해할 수 있을 것"이라고 말했다.
이러한 "접힘 공장"에 대한 지식을 바탕으로, 이전에 알려진 세포 과정을 새로운 관점에서 연구할 수 있게 되었으며, 이는 궁극적으로 의학 및 질병 치료에 도움이 될 수 있다.
참고: Nature Cell Biology, 2025; doi: 10.1038/s41556-025-01730-w
출처: 바젤 대학교




